Ejemplos de isótopos, son los átomos que pertenecen a un mismo elemento con una cantidad de neutrones distinta en los núcleos, es decir que en definitiva diferirán en cuanto a la masa atómica.
Se trata de un término que indica que en un elemento químico, los átomos sin importar su tipo se encontrarán en la tabla periódica siempre en el mismo lugar con el mismo número cuando son entre si “isótopos.
Ejemplos de isótopos, tipos
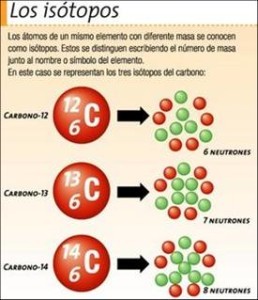
Si bien presentan un número atómico igual, el número másico es diferente.
Será radiactivo cuando presenta una relación entre el número de protones y protones que no es la correcta para poder tener una estabilidad nuclear.
Los naturales pueden encontrarse en la naturaleza de forma natural como por ejemplo el tritio, el deuterio, el protio y el hidrógeno. Para la bomba de hidrógeno es utilizado el tritio.
Los artificiales son producidos en laboratorios nucleares o en centrales nucleares. No son de una vida útil extensa ya que presentan radioactividad e inestabilidad. Por ejemplo el cesio utilizado para generación eléctrica. El iridio-192 que se utiliza para los tubos de transporte de combustible y de crudo pesado. El uranio-233 utilizado en la tecnología nuclear.
Ejemplos de isótopos, notación
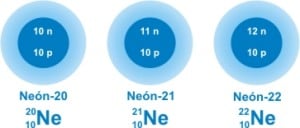
Si bien al ir descubriendo los elementos se les daba un nombre propio distinto al elemento al cual correspondían, pero al descubrirse del hidrógeno tres isótopos, a éstos se les dio por nombre: tritio, deuterio y protio, cuyo núcleo se denominó protón para el del protio, neutrón y protón para el de deuterio y dos neutrones y un protón para el tritio.
No obstante se continuó descubriendo y se observó la necesidad de infinidad de nombres y fue entonces cuando la nomenclatura se obligó a cambiar, dando lugar a un símbolo del elemento al que pertenecía, colocando a la izquierda como un subíndice, un número atómico, que devenía del número de protones presentes en el núcleo, agregando también el número másico, que significa la suma del número de neutrones y de protones.
Ejemplos de isótopos, radioisótopos

Son radiactivos con un núcleo atómico inestable, decaen al emitir partículas y energía que puede ser detectada con una película fotográfica o un contador Geiger.
Son inestables debido a una cantidad excesiva de protones o de neutrones. Es necesario que se mantenga una relación entre la cantidad de protones y neutrones para que exista estabilidad.
La energía se libera en forma de partículas que son constituidas por núcleos de helio (radiación alfa) o por partículas que están formadas por protones o electrones (radiación beta) o en forma de radiación electromagnética (radiación gamma)
Su uso es principalmente aplicado en medicina (radioterapia) como el isótopo de tecnecio que es utilizado para la identificación del bloqueo de vasos sanguíneos.
De este modo como aplicaciones se utiliza el cobalto-60 para tratar el cáncer debido a su emisión de una radiación con una energía tal que posibilita la emisión del radio pero más económica.
En el caso de tumores cerebrales es utilizado el Arsénico-74.
Cuando es necesario practicar estudios de hidrología es utilizado el bromo-82.
En la industria del petróleo se utiliza el oro-198, ya sea para la búsqueda del petróleo, ejercer la perforación de los pozos o para el estudio de la recuperación. Lee ejemplos de la primera ley de Newton.