Hoy en Ejemplos de, revisaremos las propiedades de los gases y las particularidades del estado gaseoso de la materia.
¿Qué son los gases?
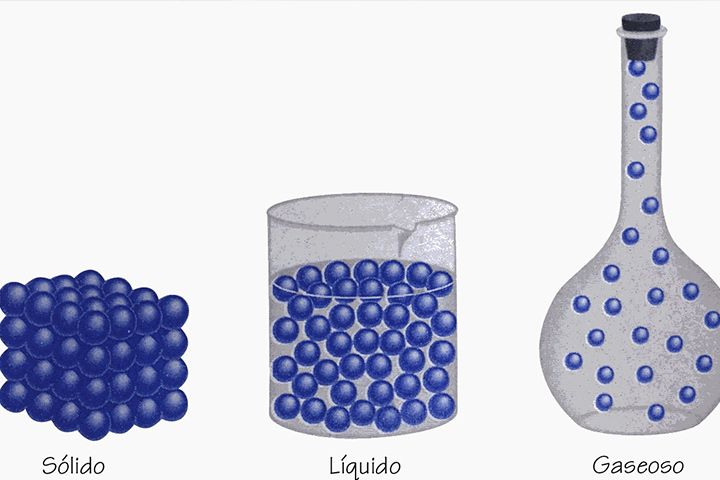
Los gases están conformados por partículas distantes que poseen gran libertad de movimiento, con alta carga de energía cinética. Su densidad es baja y esto les permite evitar los efectos de la gravedad. Los átomos que los forman se expanden hasta cubrir la totalidad del recipiente que los contiene.
A diferencia de los líquidos o sólidos, su volumen varía con facilidad según el espacio físico; de manera inherente buscan abarcar cada espacio sin importar la forma del contenedor.
Mientras más espacio exista para su adaptabilidad, las partículas son más distantes; esto demuestra la existencia de la energía cinética inmersa en los gases.
Si le damos acceso a más partículas a un recipiente que ya contenga gas, el espacio que antes era suficiente ahora se reduce, generando choque entre ellas, aumentado la temperatura y elevando la tensión existente: a esta fuerza se le llama presión.
Otra forma de aumentar esta fuerza es reduciendo gradualmente el espacio que contiene las partículas; a medida que esto sucede la fricción de los átomos se torna constante y provoca un aumento de la presión. Para medirla se han creado varias expresiones que veremos a continuación.
Medidas de presión
Bar: proviene de la palabra griega baros que significa peso.
Atm: o atmósfera: esta unidad de medida evalúa el peso que ejerce el aire sobre los cuerpos. A esto se le llama presión atmosférica.
Pascal (Pa): debe su nombre al matemático francés Blaise Pascal. Estudia la presión de un newton en relación con un metro cuadrado.
Libra por pulgada cuadrada (psi): por sus siglas en inglés, pounds four per square inch. Esta evalúa la relación peso según área.
Milímetro de mercurio (mmHg): fue creado por el físico y matemático italiano Evangelista Torricelli.
Este científico creó un barómetro con un tubo cargado de mercurio, el cual evalúa la presión atmosférica: a medida que esta aumenta, el mercurio asciende y, si disminuye, este desciende.
Torricelli (torr): debe su nombre a Evangelista Torricelli, equivale a cada milímetro que alcanza el mercurio dentro de un barómetro de mmHg.
Conversiones de Medidas de Presión
1 Bar= 0,99 atm
1 Bar= 100.000 Pa
1 Bar= 14,5 psi
1 Bar= 750,06 mmHg
1 Bar= 750,06 torr
Aparte de si compresibilidad, lo cuerpos gaseosos poseen otras características medibles como son la temperatura, el volumen y el número de partículas que los conforman.
Cuando se menciona la temperatura en los gases, se recurre usualmente a utilizar los grados Kelvin, ya que este sistema es más sensible a los cambios de temperatura que ellos sufren.
Los gases estudiados, por lo general, poseen puntos de referencia estándares (STP) que establecen presión y temperatura estándar.
Esto quiere decir que bajo condiciones controladas de presión y cantidad de gas depositado, la temperatura que se requiere es la misma para generar la fuerza de fricción molecular necesaria.
Leyes de los gases
El gas en sí mismo posee varias características que se relacionan y derivan en un comportamiento singular; para que esto ocurra se interrelacionan la temperatura, la presión, masa molecular, su volumen y el espacio en el que es contenido.
Gracias a los descubrimientos de grandes científicos a lo largo del tiempo se ha podido teorizar el desenvolvimiento y relación de cada uno de estos factores.
1. Ley de Boyle-Mariotte
Esta ley fue propuesta en el año 1662 por el físico-químico británico Robert Boyle y el físico-botánico francés Edme Mariotte. Ellos basaron fundamentalmente su estudio en la importancia del espacio físico y la forma cómo se adapta un gas a él.
Esta teoría propone que al elevar el volumen de un contenedor la presión de un gas disminuye, lo que aligera la temperatura intramolecular; pero, por el contrario, si el volumen del recipiente es achicado, la presión aumenta y la temperatura también asciende.
Para la verificación de este ley, Mariotte introdujo el gas en un cilindro, mantuvo la temperatura constante evitando su descenso o aumento, luego colocó un pistón en un extremo y redujo gradualmente el espacio, generando poco a poco un aumento de la presión.
2. Ley de Charles; Gay-Lussac
Fue una ley con bastante controversia, ya que el primero en publicarla fue el físico químico francés Louis Joseph Gay-Lussac en 1803, aunque esta proviene de un trabajo no publicado por el inventor, científico y matemático francés Jacques Charles, en el año 1787.
Establece que los gases a temperatura determinada, en relación con el espacio mantienen una presión constante; sin embargo, si elevamos la temperatura de estos cuerpos gaseosos, generamos expansión y con ello se aumenta su presión a medida que esta incrementa.
Esta ley permitió crear fundamentos para entender cómo funciona la energía cinética, pues al aumentar la temperatura molecular, esta tiende a movilizarse con más libertad, dando mayor volumen a los gases.
El experimento consiste en someter a una masa específica de gas a la elevación de la temperatura, dentro de un cilindro con pistón y peso necesario para generar compresión a temperatura inicial.
A medida que el calor aumenta, las partículas del gas son expandidas obligando el empuje del pistón en sentido contrario, evidenciando un crecimiento en el volumen de la sustancia gaseosa.
3. Ley de Avogrado
Debe su nombre al físico y químico italiano Amedeo Avogrado, quien en 1811 expuso que cuando los gases son medidos bajo la misma cantidad de presión y temperatura, estos poseen el mismo número de partículas.
En virtud de lo anterior, poseen el mismo peso molecular y, por consiguiente, un mol indistintamente del elemento gaseoso del que se trate pesa lo mismo.
Gracias a la profundidad de este estudio se estableció el número de avogrado, que es la expresión de átomos que se encuentran contenidos en un mol, el cual es aproximadamente 6,022 x 1023.
También permitió demostrar que más de un elemento gaseoso se puede fusionar, si se le aplica presión y temperatura.
4. Ley de Graham
Thomas Graham, químico británico, para el año 1829 estableció que la velocidad de difusión y efusión son inversas a las de masa y volumen de los cuerpos gaseosos.
Mientras más espacio posean los gases para expandirse, mayor será el radio que abarquen sus moléculas; por esta razón, si en un área hay demasiado choque molecular, dichas partículas ejecutarán efusión buscando separarse a zonas donde eviten el choque.
Este proceso obedece a leyes básicas de masa: si dos elementos son evaluados y uno posee mayor densidad, esto reduce su velocidad de difusión; mientras el otro, con menor peso molecular, tendrá una movilidad superior.
5. Constante del gas ideal
Es un número específico designado con la R, en honor a Henri Victor Regnault, químico y físico francés.
Es la medición de una cantidad de materia de gas ideal, evaluando el número de moles, la temperatura, el volumen y la presión a la que es sometida.
Los estudios realizados por Regnault son de importancia para la formulación de la termodinámica.
También demostró los efectos del calor gradual en las sustancias, cómo se expanden los gases a medida que aumenta la temperatura y comprobó que, cuando llegan a punto de ebullición, las moléculas de los gases no se expanden de forma uniforme.
6. Ley de los gases ideales
Establece que los gases ideales son aquellos que hipotéticamente evitan el caos inmerso en ellos; es decir, los choques en sus partículas generan elasticidad, por consiguiente, la fuerza de atracción y repulsión es baja, donde la energía cinética aumenta con el ascenso de la temperatura.
La formulación de un gas ideal se da a través de una ecuación de los gases ideales en la que expresa que el número de moles es igual en las masas gaseosas de proporciones idénticas; el volumen y la presión son proporcionales uno a otro; mientras que la temperatura es inversamente proporcional a ellos.
Ahora conoces más sobre el estado gaseoso, ¿cierto? Comparte con tus compañeros esta información y cuéntanos qué tan útil ha sido para resolver tus tareas.
Tu opinión es importante para nosotros. ¡Haz tus comentarios!
Ver También:
- Ejemplos de los estados de la materia
- Ejemplos de materia
- ¿Cuáles Son los Estados De La Materia Y Qué Es La Materia?