Ejemplos de destilación, son métodos de separación a partir de la condensación y vaporización de componentes disueltos sólidos, líquidos o de gases.
Se lleva a cabo mediante puntos de ebullición de la sustancia o mezclas de éstas.
Ejemplos de destilación, simple
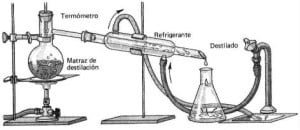
Como ejemplos de destilación, en la simple también llamada sencilla, los vapores que se producen se canalizan de inmediato hacia el condensador que lleva a cabo la condensación, es decir que los enfría, dando por resultado un destilado no puro.
La ley de Raoult es el método por el cual se calcula la temperatura y presión del separador. Se separan sustancias que pueden tener una diferencia de 100 a 200º C, pues se crearían azeótropos en el caso de una diferencia menor.
Cuando se lleva a cabo este tipo de destilación, la entrada de agua debe ser colocada en la parte inferior del refrigerante, de modo tal que pueda ser llenado por completo. Puede ser utilizada una simple para la separación de un sólido disuelto en uno o dos líquidos con una diferencia que supere los 50º C en el punto de ebullición.
Ejemplos de destilación, fraccionada
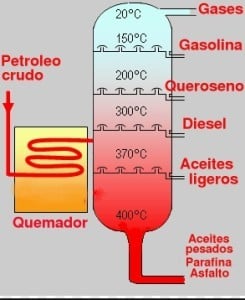
La fraccionada es una variante de la anterior, utilizada para la separación de líquidos con parecidos puntos de ebullición.
La columna de fraccionamiento es la diferencia con la simple, pues de este modo es posible que los vapores que ascienden tengan un mayor contacto con el líquido condensado que descenderá, debido a la utilización de distintos platos, facilitando de este modo que los vapores intercambien calor.
Ejemplos de destilación, al vacío
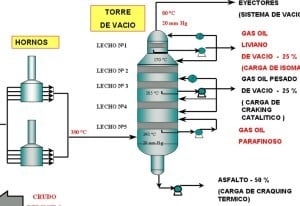
La destilación al vacío es un sistema que genera vacío parcial. Se utiliza para la destilación de sustancias con un punto de ebullición más bajo a lo normal, por ejemplo para la purificación de sustancias inestables como las vitaminas.
Al crearse un vacío es posible la reducción a la mitad del punto de ebullición de una sustancia.
Es complementaria a la destilación del crudo en la industria petrolera.
Se obtiene de este modo gas oil ligero de vacío, pesado de vacío y residuo de vacío.
La azeotrópica rompe un azeótropo. Es común en la mezcla de agua y etanol. El etanol con una técnica normal puede purificarse un 95%. Al concentrarse en un 95,5% agua/etanol, ambos equiparan los coeficientes de actividad, equiparando también la concentración del vapor de las mezcla al mismo porcentaje de 95,5%, por lo que no resultaría efectiva una nueva destilación.
La mejorada es una opción más barata que la convencional como las reactiva o la alterna. Se utiliza con una mezcla de dos o más compuestos con parecidos puntos de ebullición, con una volatilidad relativa por debajo a uno.
La seca se lleva a cabo por el calentamiento de materiales sólidos en seco sin utilización de líquidos solventes para generar productos gaseosos que puedan ser condensados en sólidos o líquidos. Con esta técnica es posible obtener sustancias sólidas como madera o carbón. También sirve para la división de sales a partir de termólisis y para la obtención de gases útiles.
Puedes visitar: ejemplos de mezclas heterogéneas.