Ejemplos de reacciones químicas, son los procesos llevados a cabo a través de la termodinámica dando por resultado la transformación de reactantes, sustancias que son transformadas por la acción energética, tras lo cual cambian sus enlaces y la estructura molecular convirtiéndose entonces en otras sustancias denominadas “productos.
Compuestos o elementos tal como pueden ser esas sustancias.
La ecuación química es la representación química de esas reacciones.
Ejemplos de reacciones químicas, clases
En una reacción química inorgánica puede ser de neutralización o reacción ácido-base o redox, pero también se pueden clasificar según el tipo de producto que da como resultado la reacción o según el mecanismo de reacción.
Siendo las reacciones de síntesis de sustitución doble, de sustitución simple o de descomposición.
La de síntesis son los compuestos o los elementos sencillos que al ser unidos forman otro compuesto, cuya representación es:
A+B será AB, siendo que ambos están representando una sustancia química. Por ejemplo 2Na(s) +Cl2 (g) será 2NaCl(s) como síntesis del cloruro de sodio.
De descomposición es un compuesto fragmentado en compuestos más sencillos o elementos más sencillos. Uno solo de los reactivos se convertirá en productos o zonas.
Por ejemplo AB será A+B, siendo que ambos están representando una sustancia química cualquiera.
La descomposición del agua es un ejemplo de esta reacción:
2H2O (I) será 2H2(g) + O2(g)
De simple sustitución o de desplazamiento es cuando un elemento reemplazará a otro en un compuesto.
A+BX será AC+B, siendo que los tres están representado una sustancia química cualquiera.
Por ejemplo en una reacción donde el hierro como (Fe) desplaza al (Cu) cobre en el (CuSO4) sulfato de cobre.
Donde Fe +CuSO4 dará FeSO4+Cu
De doble sustitución o doble desplazamiento cuando se forman dos sustancias distintas por la acción de los iones que en un compuesto modifican los lugares con los iones de otro compuesto.
Por ejemplo: AB + CD será AD + BC, siendo que los cuatro están representando una sustancia química cualquiera.
NaOH + HCl dará NaCl + H2O como ejemplo de esta reacción.
Ejemplos de reacciones químicas, orgánica
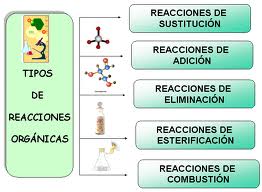
Como reacción química orgánica pueden ser compuestos tales como los alcoholes, las cetonas, los aldehí, losa alquinos entre otros.
Como grupos funcionales pueden ser nitro, carbonilo, hidroxilo, enlaces dobles y triples.
Ejemplos de reacciones químicas, velocidad
La velocidad de la reacción puede ser afectada por distintos factores como:
Su naturaleza, ya que dependiendo de ello tendrá una mayor o menor velocidad de reacción.
Su concentración también tiene que ver con la velocidad de la reacción porque de acuerdo a la ley de velocidad la frecuencia de colisión aumentará al aumentarse la concentración de los reactantes.
La presión incide significativamente de acuerdo a la concentración del gas.
La temperatura al ser alta influirá en una mayor producción de energía, proporcionará una mayor colisión de partículas al aumentar la velocidad, según la teoría de las colisiones.
Cuando en colisión hay un número alto de partículas con energía de activación adecuada para una reacción, la velocidad aumenta dando por resultado una colisión exitosa.
Si bien la velocidad de reacción es duplicada con un aumento de temperatura de cada 10º C, según la ecuación de Arrhenius, no siempre se da este caso, ya que si se almacena el carbón a temperatura ambiente no arde pero sí lo hará si se encuentra en presencia del oxígeno.
El orden hace un registro sobre la reacción y como ésta incide en la presión.
Ejemplos de reacciones químicas, su rendimiento
Dependerá del calor expuesto a la reacción.
El porcentaje del rendimiento es igual a la cantidad real del producto / la cantidad ideal del producto multiplicado por 100:
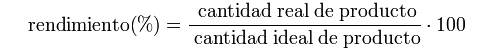
A partir de una reacción química por lo general se obtiene una cantidad de producto menor que la teórica, dependiendo de factores tales como las reacciones secundarias que pudiesen haberse producido o la pureza del reactivo.
Difícilmente pueda ser posible un rendimiento al 100% de recuperación. Lee: ejemplos de compuestos.
[…] Las reacciones químicas descomponen las sustancias, pero al separar los elementos se perderán las propiedades de la sustancia pura. Puedes visitar: ejemplos de reacciones químicas. […]
[…] las mezclas son ejemplos de reacciones químicas en este caso beneficiándote para la limpieza del acero […]