La materia está conformada por átomos. Todo cuánto existe y nos rodea se encuentra conformado por cientos de miles de moléculas cuya división más pequeña es el átomo. Su concepto proviene del Griego y significa “que no se puede dividir”.
El átomo se encuentra a su vez conformado por un núcleo que gira constantemente dentro de él de forma elíptica, así como por protones, neutrones y electrones. Los átomos están compuestos de energía eléctrica y la producen para poderse mantener.
Los protones son la carga positiva, los neutrones la carga neutra y los electrones la carga negativa. Para que pueda existir un equilibrio entre los átomos de las diferentes sustancias químicas, estos se ven obligados a unirse a otros en un enlace que puede ser covalente o iónico.
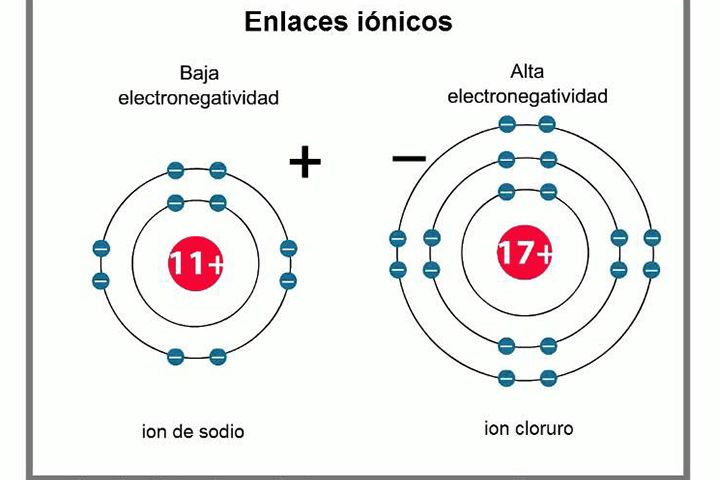
Enlaces Iónicos
Los átomos requieren equilibrarse y buscan siempre formar un estado estable, es decir, de menor energía. Para ello actuarán según sus necesidades y composición química, bien tomando electrones de otros átomos o bien desprendiéndose de ellos.
Algunos optan por equilibrarse usando lo que se conoce como la regla del octeto, dónde buscan tener dentro de su órbita de valencias la cantidad de ocho electrones. Cuando el átomo gana o pierde electrones producen partículas cargadas conocidas como iones.
Los iones se dividen a su vez en cationes o iones positivos, que se generan al perder un electrón, y los aniones o iones negativos, que se generan al ganar un electrón.
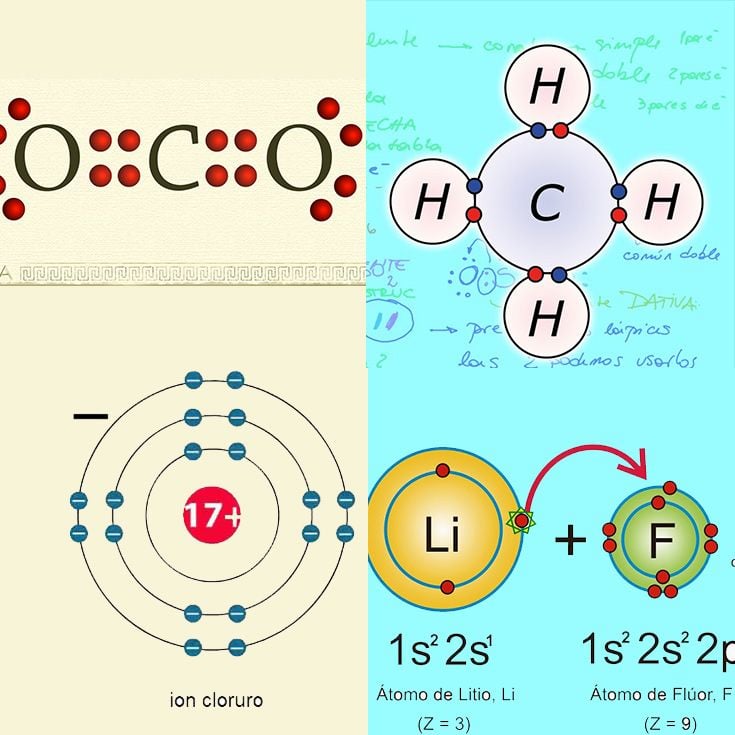
Los enlaces iónicos se realizan gracias a la atracción que las cargas opuestas de los iones generan entre sí.
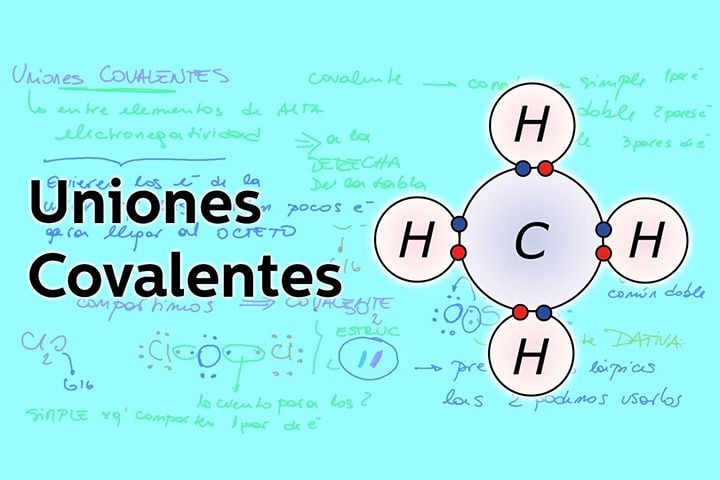
Enlaces Covalentes
Otra forma de ganar estabilidad para los átomos es compartir las cargas, en vez de ganar o perder electrones totalmente, los comparten formando así enlaces covalentes.
Este tipo de enlaces suele presentarse frecuentemente en los organismos vivos. Ejemplos de enlaces covalentes son el Acetileno C2H2 y el Benceno C6H6.
Los enlaces covalentes también pueden sub dividirse en polares y no polares.
Tipos de enlaces covalentes
Los enlaces covalentes polares son aquellos en los que el compartir de los electrones no es equitativo, formando así un ligero desequilibrio que hace que los electrones estén más cercanos a un átomo que al otro y que se produzcan ligeras cargas positivas y negativas dentro de la molécula.
Un ejemplo de este enlace lo vemos en el agua H2O donde el oxígeno al tener una electronegatividad más alta que el hidrógeno se equilibra con este formando la molécula de agua.
De la electronegatividad presente entre los átomos dependerá que un enlace sea polar o no. Cuando un elemento es más electronegativo que el otro el enlace será polar, pues se crean polos, y las cargas de cada polo serán ligeramente negativas o ligeramente positivas según corresponda.
Por su parte, los enlaces covalentes no polares son aquellos formados entre dos átomos del mismo elemento, o entre varios átomos de elementos diferentes que comparten entre sí electrones de una forma un poco equitativa.
Un ejemplo de esto lo vemos en las cadenas de carbono del metano, dónde el carbono al tener cuatro electrones en su capa externa necesita de cuatro electrones más para equilibrarse completando el octeto, estos otros cuatro electrones los toma del hidrógeno y forma el CH4.
Otro tipo de enlace covalente es el conocido como dativo o coordinado. En este tipo de enlaces dos átomos comparten solo dos electrones, pero estos son aportados por un solo átomo.
Para que esto ocurra el átomo que comparte sus electrones debe ser un elemento con un par de electrones libres y otro deficiente como lo es el hidrógeno. Un ejemplo de este enlace es el Amonio NH4.
Sustancias con compuestos covalentes
Los enlaces covalentes están presentes en las sustancias moleculares y los cristales covalentes.
En los cristales covalentes los enlaces forman redes tridimensionales dónde los átomos se unen entre sí. Estas redes son fuertes y muy difíciles de romper. Sus propiedades principales son su dureza, un punto de fusión muy elevado, son pocos solubles sin importar el disolvente y no son buenos conductores de la electricidad.
Algunos de estos cristales covalentes son: el diamante, el cuarzo, el nitruro de boro, entre otros.
Las sustancias moleculares por su parte son aquellas donde un número determinado de átomos se unen por medio de un enlace covalente formando moléculas. El enlace formado resulta ser tan fuerte que es muy difícil de romper y se requiere de la fuerza intermolecular para lograrlo.
Las sustancias moleculares están conformadas por estás fuerzas intermoleculares. Sus propiedades principales son:
-Se presentan en los diferentes estados de la materia
-Tienen bajos puntos de fusión y ebullición
-Son blandas y de solubilidad variable
-Igualmente son malos conductores eléctricos.
Algunas de estas sustancias son: di hidrogeno, bromo, agua, amoníaco.
Ejemplos de enlaces covalentes:
1- Butano
2- Benceno
3- Propano
4- Etano
5-Acetileno
6- Metano
7- Amonio
8- Oxígeno
9- Bromo
10- Agua
11- Dióxido de carbono
12- Alcohol Etílico
13- Alcohol Metílico
14- Alcohol Propílico
15- Acido Fórmico
16- Ácido Acético
17- Ácido Butírico
18- Ácido Propiónico
20- Monóxido de Carbono
21- Nitrógeno Molecular
22- Hidrógeno Molecular
23- Iodo
24- Cloro
25- Amoníaco
26- Cuarzo
27- Grafito
28- Diamante
29- Helio
30- Freón
31- Sílice
32- Glucosa
33- Parafina
34- Diésel
35- Nitrógeno
36- Ácido Clorhídrico
37- Tetracloruro de Carbono
38- Isobutano
39- Hexano
40- Octano
Los enlaces covalentes son un proceso químico natural que realizan los átomos para poder equilibrarse y mantener el nivel de energía que les permite formar molécula a molécula una substancia.
Todo lo que vemos o tocamos, incluso lo abstracto como el aire y el oxígeno está conformado por átomos que realizan de modo constante estos enlaces y que de esta forma aportan un constante equilibrio a lo que conocemos como mundo.
¿Te ha resultado de utilidad este artículo? ¡Déjanos tu opinión en los comentarios!